Gojenie ran to złożony proces biologiczny, którego celem jest przywrócenie integralności uszkodzonej tkanki. Jest to dynamiczna interakcja komórek, macierzy zewnątrzkomórkowej (ECM) i czynników wzrostu, prowadzona w ściśle regulowanej sekwencji. Proces ten dzielimy na kilka nakładających się faz: hemostaza, zapalenie, proliferacja i remodelowanie.
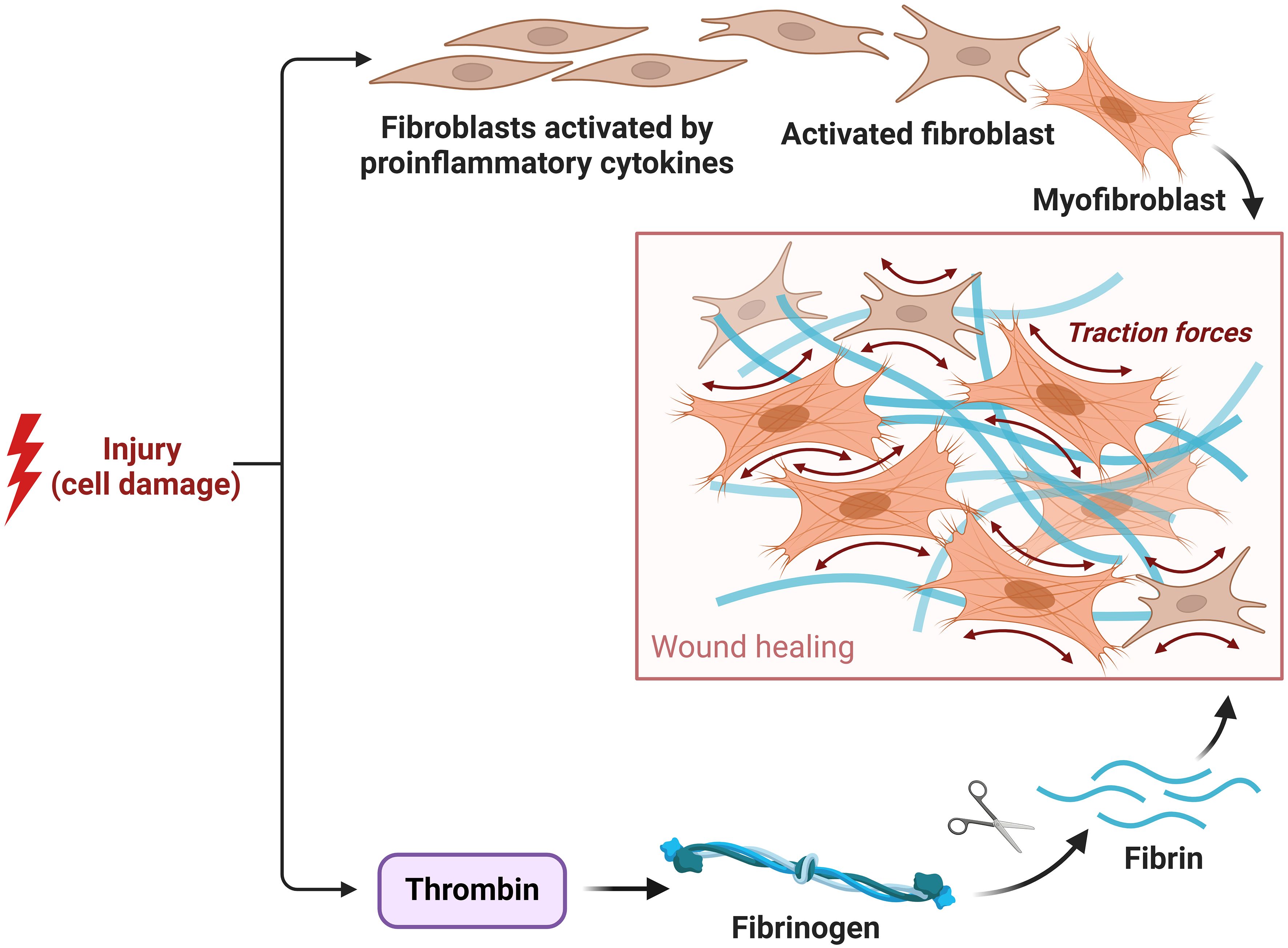
Fibroblasty odgrywają kluczową rolę w fazie proliferacji i remodelingu gojenia ran. Ich pochodzenie jest zróżnicowane, obejmując lokalną proliferację fibroblastów rezydentnych, rekrutację z szpiku kostnego (fibrocyty) i transformację mezenchymalno-nabłonkową (EMT) komórek nabłonkowych. Rozwój tych komórek w miejscu uszkodzenia jest stymulowany przez czynniki wzrostu, takie jak transformujący czynnik wzrostu beta (TGF-β) i płytkowy czynnik wzrostu (PDGF), wydzielane przez komórki zapalne i płytki krwi.
Fibroblasty odpowiedzialne są za syntezę składników ECM, w tym kolagenu, elastyny i proteoglikanów, tworząc rusztowanie, które podtrzymuje proliferację komórek i naskórkowanie. Badania in vitro wykazały, że fibroblasty różnicują się w miofibroblasty, komórki kurczliwe, które przyczyniają się do zamknięcia rany. Proces ten jest zależny od stymulacji TGF-β i ekspresji α-SMA (alfa-aktyny mięśni gładkich). Nadmierna aktywność miofibroblastów może prowadzić do powstania blizn przerostowych i keloidów.
Obecne rozumienie roli fibroblastów w gojeniu ran koncentruje się na modulacji ich aktywności w celu poprawy wyniku leczenia. Strategie terapeutyczne obejmują stosowanie czynników wzrostu, matryc ECM i komórek macierzystych, aby stymulować proliferację fibroblastów i syntezę ECM w kontrolowany sposób. Przykładowo, badania kliniczne z wykorzystaniem plazmy bogatopłytkowej (PRP) wykazały przyspieszone gojenie się owrzodzeń cukrzycowych stóp, co przypisuje się zwiększonej rekrutacji i aktywności fibroblastów. Ponadto, leki hamujące TGF-β są badane jako potencjalne terapie w zapobieganiu bliznom.