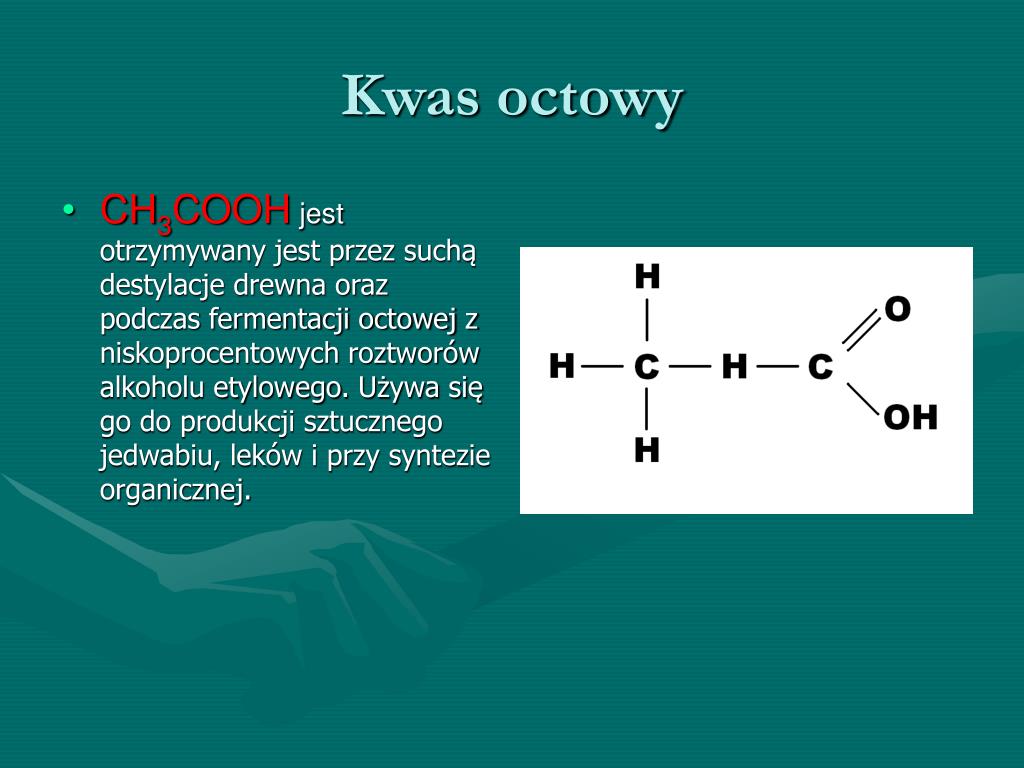
Kwas octowy, powszechnie znany jako ocet, jest kwasem karboksylowym, ponieważ posiada charakterystyczną grupę funkcyjną – grupę karboksylową (-COOH) w swojej strukturze. To właśnie obecność tej grupy decyduje o jego przynależności do tej klasy związków chemicznych.
Jak to działa? Grupa karboksylowa jest odpowiedzialna za właściwości kwasowe kwasu octowego. Składa się z atomu węgla połączonego wiązaniem podwójnym z atomem tlenu (C=O) i wiązaniem pojedynczym z grupą hydroksylową (OH). Atom wodoru w grupie hydroksylowej (OH) ma tendencję do odłączania się jako jon wodorowy (H+) w roztworze wodnym. To właśnie uwalnianie jonów H+ definiuje kwasowość substancji.
Pomyśl o occie, który masz w domu. Kiedy rozcieńczasz go wodą, czujesz jego kwaśny smak – to właśnie efekt działania jonów H+ pochodzących z grupy karboksylowej kwasu octowego. W reakcji z zasadami, kwas octowy neutralizuje je, tworząc sole (octany).
Dlaczego to ma znaczenie? Fakt, że kwas octowy jest kwasem karboksylowym, determinuje jego właściwości i zastosowania. Wykorzystuje się go w przemyśle spożywczym (konserwacja żywności), chemicznym (produkcja tworzyw sztucznych, leków), a nawet w gospodarstwach domowych (czyszczenie, odkamienianie). Zrozumienie, że kwas octowy jest kwasem karboksylowym, pozwala przewidzieć jego zachowanie w różnych reakcjach chemicznych i zrozumieć, dlaczego ma takie, a nie inne zastosowania.
Innymi słowy, przynależność kwasu octowego do rodziny kwasów karboksylowych tłumaczy jego kwaśny charakter i szerokie spektrum zastosowań, które obserwujemy na co dzień.